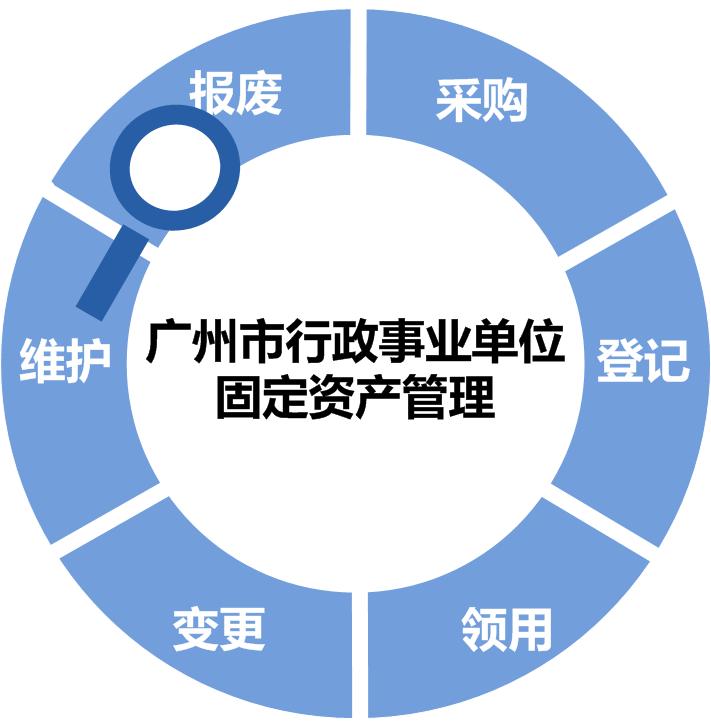
根据穗财资〔2012〕327号和穗财资〔2015〕399号文件要求,为广州市行政事业单位提供办公...

一、项目介绍 研制包括评价原则、评价内容、评价流程、评价准则和评价报告等内容的标准...
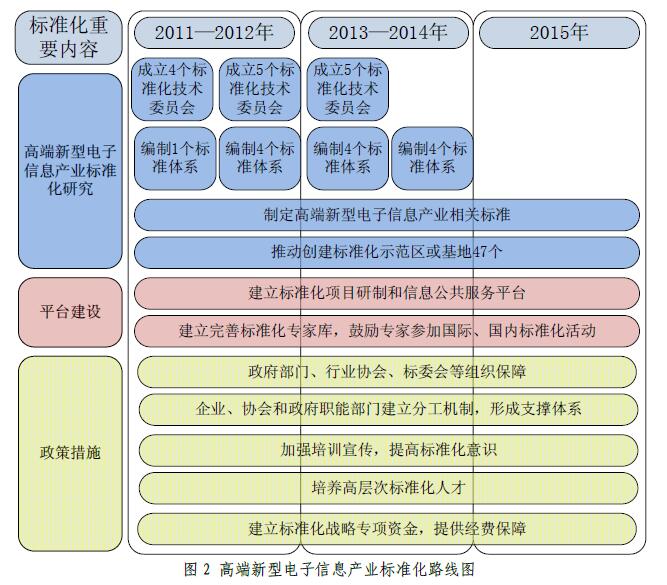
一、项目介绍 结合广东省高端新型电子信息产业的发展趋势,对产业的边界界定和范围划分...



当前位置>首页>我们的服务 > 物品编码 > 条码应用推广 >
发布时间:2021-12-14 15:39:06
医疗器械唯一标识(UDI) 是指在医疗器械产品或者包装上附载的,由数字、 字母或者符号组成的代码, 用于对医疗器械进行唯一性识别。UD标识包括产品标识和生产标识,产品标识是识别医疗器械上市许可持有人、医疗器械型号规格和包装的唯一代码. 生产标识是由医疗器械生产过程相关信息的代码组成,根据监管和实际应用需求,可包含医疗器械序列号、生产批号,生产日期失效日期,生产标识可使用应用标识符表示。

步骤一:申请厂商识别代码
医疗器械生产市场主体通过中国物品编码中心网上业务大厅(www .gs1cn.org)或“中国编码”APP申请厂商识别代码。
步骤二:分配UDI编码标识
UDI=DI+PI,DI是指产品标识,用于识别医疗器械型号规格和包装的唯一代码,可使用全球贸易项目代码(GTIN) 表示;PI是指生产标识,标识医疗器械生产信息如序列号、生产批号、生产日期、失效日期等,可分别使用应用标识符Al(21),Al(10),A(11), Al(17)表示。
步骤三:选择UDI数据载体
企业根据生产实际情况,选择UDI-维码、二维码或RFID标签,参照由中国物品编码中心编译的《GS1医疗自动识别码与采集指南》执行。
步骤四:UDI数据同步
企业凭条码卡号密码登录中国商品信息服务平台(www.gds.org.cn),开通“UDI数据管理服务”,可采用在线填报和EXCEL批量上传等方式完成UDl数据发布,数据可同步到国家药监局UDI数据库,完成UDl数据备案。
企业如果有办理UDI相关业务需求,可拨打中国物品编码中心电话:400-7000-690或中国物品编码中心广州分中心咨询电话:020-83228628.